担当:宇野、冨塚
『生命のオペレーティングシステム』ヒト人工染色体(HAC)
HACはヒト染色体の安定維持・分配に必要なセントロメアやテロメアという配列のみを含むよう操作・改変されたミニ染色体です。HACには、従来の遺伝子工学技術(~十万塩基対が対象)では扱うことが難しかった、百万~一千万塩基対の巨大なDNA断片(アプリケーション)が搭載可能であり、ヒト細胞やマウス個体に様々な機能を付与することができます(下図)。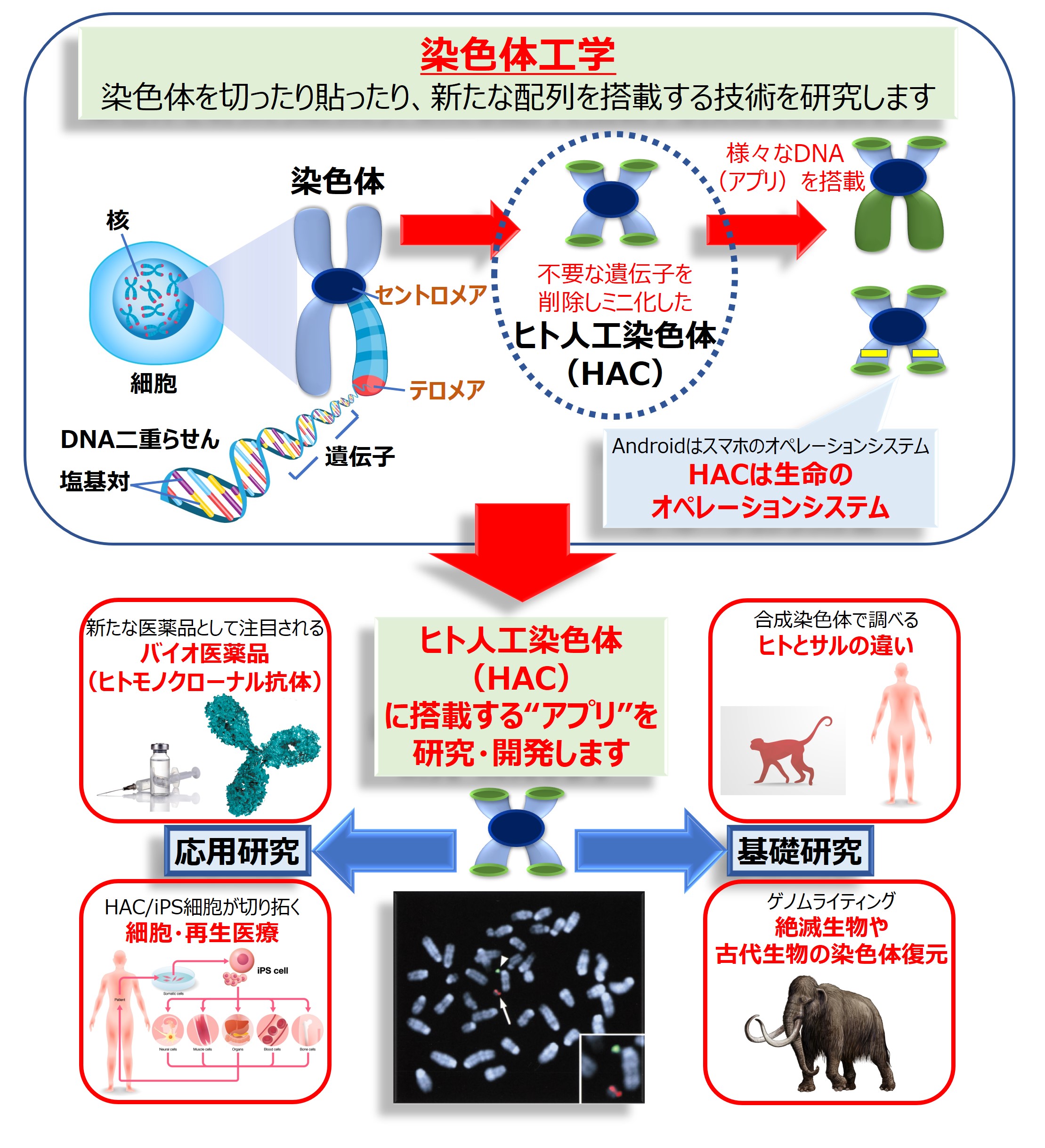
私達は、これまで鳥取大学(染色体工学研究センター)と共同で開発してきた、我が国独自のHAC技術を用いて以下のような研究開発を行っています。
◆再生医療用ヒト人工染色体ベクター開発
再生医療は、難治性疾患に対する画期的な治療法になると期待されていますが、細胞に望みの性質を付与するための遺伝子改変用ベクターには、ウイルスなどゲノム挿入型以外の選択肢が少なく、宿主ゲノムに傷をつけることや発現の安定性という点が課題となっています。正常染色体同様に単一コピーが宿主ゲノムと独立して維持され、導入遺伝子のサイズに制約がないHACを使えば、複数の遺伝子を適切な制御のもと発現させることも可能になります。具体的には、HAC導入iPS細胞から誘導されるCAR-T細胞を用いたガン治療用細胞医薬の開発や、組織再生因子を高産生する細胞医薬の開発、臨床応用可能なHACベクター構築などの研究を行っています。
*AMED再生・細胞医療・遺伝子治療実現加速化プログラム(再生・細胞医療・遺伝子治療研究開発課題(基礎応用研究課題))(2023-2025、研究分担者 宇野)『ヒト人工染色体(HAC)ベクターによるデザイナーiCAR-T細胞創出プラットフォーム開発』
■関連プレスリリース(2022.03.17、リンク):ヒトiPS/間葉系幹細胞等のヒト人工染色体ベクターによる遺伝子操作法を開発 -- 染色体工学技術により再生医療・がん治療研究を加速
■関連プレスリリース(2021.01.18、リンク):染色体レベルでのヒト iPS 細胞のエンジニアリングに成功 ~遺伝子細胞治療、疾病モデル細胞の作製、創薬研究等への応用へ期待~
◆ゲノム合成
ゲノム研究はいよいよ塩基配列を読む時代から、それを書く時代に変わろうとしています。設計・合成されたDNA配列が実際に細胞の中でどのような機能を発揮するかを解析することは、ゲノムサイズが小さな微生物以外では困難でしたが、これをヒト細胞で可能にするという目的においてもHACは威力を発揮すると期待されています。私たちはHACを活用して、ヒト染色体が正常に機能するために必要な最小領域の特定(ミニマル化)や、他の動物種との比較による、ヒトをヒトたらしめている配列を特定する研究を進めています。
*CREST ゲノム合成 (2018-2023、研究分担者 冨塚)
「ヒト/マウス人工染色体を用いたゲノムライティングと応用」
◆免疫系ヒト化動物を活用した抗感染症ヒト抗体創成基盤の確立
COVID-19の脅威を背景に、感染症に対する予防・治療薬の研究開発への社会的要請が高まっています。本研究課題では、重症化リスクの高い感染者や曝露後の予防等に有効な中和抗体療法の早期実現を目指し、独自開発した(1)完全ヒト抗体産生動物、(2)ゲノム合成技術、(3)mRNA創薬技術等を融合して、様々な感染症に対する予防・治療用ヒト抗体医薬候補品を迅速に創成する「Express
Hu-mAbシステム」の確立に取り組みます。
*革新的先端研究開発支援事業(AMED-CREST)(2021-2026、研究代表者 冨塚)
■関連プレスリリース(2021.10.07、リンク):「革新的先端研究開発支援事業(AMED-CREST)」に当研究室を代表とする課題が採択 -- 先端技術を駆使して感染症と闘う抗体医薬を創る
■関連プレスリリース(2022.04.12、リンク):完全ヒト抗体産生マウスの作製に成功 -- ヒト抗体の多様性を再現・抗体医薬品創出へ期待
◆バイオ医薬を望みの組織に送達する新技術(AccumBody)の開発
脳、腸、筋肉組織移行性抗体と生理活性分子(抗体、増殖因子・サイトカイン、核酸等)の組み合わせにより、生理活性分子単体では達成し得なかった薬効、動態を実現し、多発性硬化症、炎症性腸疾患、Duchenne
型筋ジストロフィー等に対して画期的な治療効果をもたらす次世代複合バイオ医薬品を創出する研究を進めています。
*AMED先端的バイオ創薬等基盤技術開発事業(2019-2023、研究分担者 冨塚)
「完全ヒト抗体×ファージライブラリによる組織特異的移行性抗体AccumBodyの開発と次世代複合バイオロジクスへの応用」
*染色体とは:遺伝情報を担うDNAと蛋白質 からなる 構造体で、特定の色素で染め出されることが名前の由来です。多数の遺伝子が染色体上に配列していることから、『遺伝子の集合体』という意味でも使われます。ヒトは46本、マウスは40本、チンパンジーは48本の染色体を持っています。
当研究室では、独自の染色体工学技術に加え、下記(*)のような、さまざまな技術を駆使した研究を行います。
*iPS細胞/ES細胞の培養・分化、オルガノイド培養、ゲノム編集(CRIPR-CAS9)、蛋白質工学、ノックアウトマウス、トランスジェニックマウス