ようこそ細胞情報科学研究室へ
こんにちは。私たちのホームページを訪れていただき有難うございます。
私たちの研究室では、生化学的、細胞生物学的、遺伝学的手法を用いて、翻訳後修飾関連酵素、がん、オートファジーに関する研究を行っています。
大学院生と学部4年生を併せて、10人程度のアットホームな研究室です。
細胞情報科学研究室では、一緒に研究してくれる学部生、大学院生を募集していま
す。是非一度、見学に来てください。質問のある方は、どんな質問でも結構ですので、
気軽にお問い合わせください。皆さんと一緒に研究できることを心待ちにしております。
伊藤 昭博
問い合わせはこちらから↓
aito(a)toyaku.ac.jp
研究テーマ
タンパク質の機能はゲノムDNA中にコードされているアミノ酸配列に基づいていますが、多くのタンパク質は翻訳時あるいは翻訳後に様々な修飾を受けることによってその機能が調節されていることが知られています。タンパク質の翻訳後修飾には様々な種類がありますが、リジン残基はユビキチン、SUMO (small ubiquitin-like modifier) などのタンパク質による修飾に加えて、アセチル基、メチル基などの化学基による修飾など、非常に多様な翻訳後修飾を受けることが知られています。これらの修飾は、タンパク質の安定化、局在、活性、タンパク質間相互作用などを変化させ、タンパク質を介した細胞内シグナルに重要な働きをしています。当研究室では、リジン残基上で起こる多様な翻訳後修飾の中でもアセチル化および、最近見つかった長鎖アシル化修飾に特に注目し、研究を行っています。
NAD+依存的リジン脱アセチル化酵素サーチュインに関する研究
サーチュインは大腸菌からヒトまで種を超えて保存され、NAD+依存的リジン脱アセチル化酵素活性を有するタンパク質です。ヒトでは7種類のアイソザイム (SIRT1—7) が存在し、老化、代謝、がん化などの様々な生命現象に関わっていることが知られています。サーチュインはリジン脱アセチル化酵素活性に加えて、リジン残基上でおこる様々なアシル基を脱アシル化する酵素活性を有していることが最近分かってきました。ヒトの7種類の中のサーチュインの中でも主に細胞質に局在するSIRT2が、ミリストイル基やパルミトイル基などの長鎖アシル基を脱アシル化する酵素活性を有していることが示されています。当研究室ではSIRT2に注目し、研究を行っています。
リボゾームで翻訳された多くのタンパク質は、翻訳後に様々な修飾を受けることによってその機能が調節されています。この修飾が正常に行われないと、がんなどの疾患発病の原因になることが知られています。したがって、タンパク質の修飾酵素は重要な創薬分子標的であると考えられています。数多くある翻訳後修飾の中でも、リジン残基上で起こる翻訳後修飾は、ユビキチン化、SUMO化、アセチル化、メチル化など多種多様であり、またこれら修飾は疾患と密接に関与することが知られています。実際、ヒストン脱アセチル化酵素 (HDAC) の阻害剤は抗がん剤として臨床の場で使用されています。当研究室では細胞のがん化に関わるリジン修飾酵素あるいはリーダータンパク質に着目し、創薬を指向した化合物探索研究を行っています。
タンパク質のリジンアセチル化/アシル化修飾に関する研究
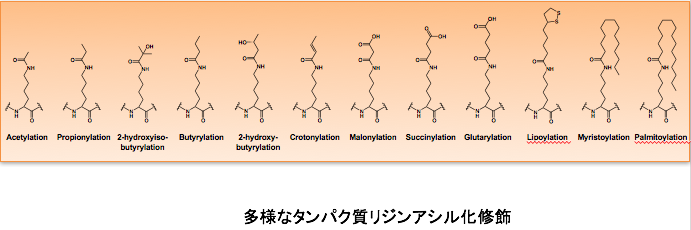
研究内容
近年の質量分析装置の発達などにより、ヒトの細胞内には1,000種類以上のタンパク質がアセチル化されていることが示唆されています。しかし、アセチル化の機能が明らかになったのはごく一部です。私達はこれまで、がん抑制遺伝子産物であるp53、翻訳関連因子であるeIF5A、がんの転移、浸潤に重要なアクチン結合タンパク質であるコータクチンなど、主にがんに関与するタンパク質のアセチル化について研究を行い、アセチル化によるそれらタンパク質の機能変換について明らかにしてきました。引き続き、アセチル化によるタンパク質機能調節による細胞機能制御とがんなどの疾患との関係について明らかにしていきます。 加えて、タンパク質のリジン残基上では多様なアシル化修飾されることが分かってきました。その中には、ミリストイル基、パルミトイル基などの長鎖アシル化修飾が含まれます。しかし、これらの長鎖アシル化修飾が細胞内でどのような役割を担っているのかはほとんど分かっていません。リジン長鎖アシル化されるタンパク質を網羅的に探索し、長鎖アシル化修飾の生理的意義とがんなど疾患との関与の解明を目指します。
NAD+依存的リジン脱アセチル化酵素サーチュインに関する研究
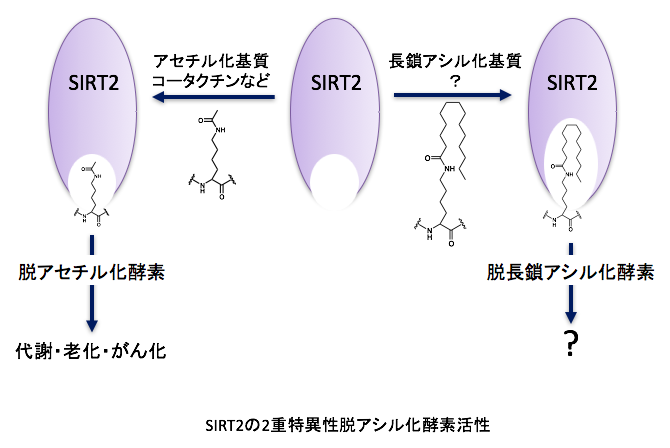
研究内容
SIRT2主に細胞質に局在するNAD+依存的リジン脱アセチル化酵素です。私達はSIRT2が翻訳関連因子であるeIF5A、がんの転移、浸潤に重要なアクチン結合タンパク質であるコータクチンの脱アセチル化酵素として機能すること、さらに膵臓がん細胞の生存に重要であることを明らかにし、SIRT2が創薬分子標的になることを示してきました。そこで、SIRT2の阻害物質の探索を行い、SIRT2の脱アセチル化酵素活性を選択的に阻害する化合物の取得に成功しました。得られた阻害剤とSIRT2複合体のX線共結晶構造から、SIRT2の基質結合部位の奥に疎水的な空間が存在することを見出し、化合物はその疎水的空間に結合することが分かりました。この疎水的な空間は、ミリストイル基やパルミトイル基などの長鎖アシル基が結合するために必要な空間であることを見出し、SIRT2のリジン脱長鎖アシル化酵素活性の分子機構を明らかにしました。一方で、SIRT2の脱長鎖アシル化酵素の生理的意義は全く分かっていません。分子生物学、生化学の手法に加えて、化合物を用いて生命現象を明らかにするケミカルバイオロジーの手法を用いて、SIRT2のリジン脱長鎖アシル化酵素の細胞内での役割を明らかにします。
リジン翻訳後修飾を標的とした化合物探索研究
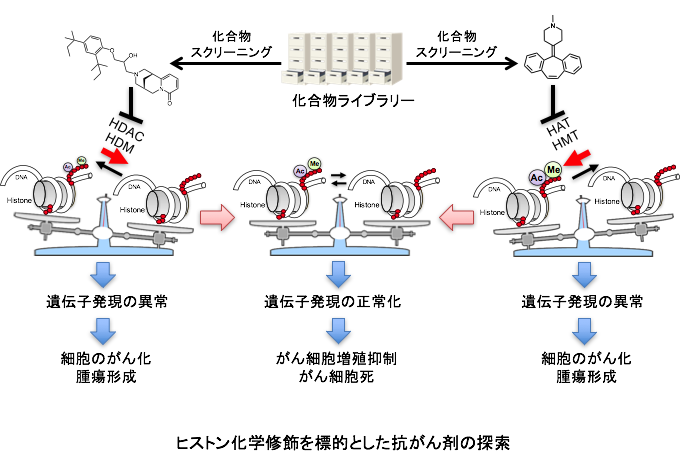
研究内容
がんの原因は、遺伝子の変異だけでなく、エピジェネティックな遺伝子の発現の異常も関与することが明らかになってきました。エピジェネティックな遺伝子発現を制御する分子基盤は、ヒストンのリジン残基上で起こるアセチル化、メチル化などの化学修飾です。これらの化学修飾は修飾酵素によって可逆的に制御されており、このバランスがくずれると発がんに繋がると考えられています。また、修飾部位と結合するリーダータンパク質によって、修飾の情報が認識されることが知られています。したがって、これら修飾酵素あるいは、リーダータンパク質は創薬分子標的として有望です。私達はこれまで、細胞のがん化に関わる修飾酵素の活性を検出するアッセイ系を構築し、化合物スクリーニングを行ってきました。がんと密接に関わる修飾酵素およびリーダータンパク質を標的とした化合物探索研究を行います。同定した化合物は、細胞のがん化における修飾酵素、リーダータンパク質の役割を解明するためのツールとして使用するだけでなく、それら化合物を基に創薬化学、構造生物学、計算科学の専門家との共同研究による創薬研究を実施し、薬の種となる化合物の取得を目指します。
